PROTAC的淘金热
靶向蛋白质降解的发展可谓如日中天,2021年7 月,辉瑞公司向 Arvinas 支付了 6.5 亿美元的预付款,外加 3.5 亿美元的股权投资,用于联合开发 PROTAC 降解剂,目前处于第二阶段试验阶段。
2021年8 月,拜耳以 15 亿美元的预付款和5 亿美元的潜在里程碑付款收购药物研发公司Vividion Therapeutics。而Kymera 宣布与赛诺菲达成 21.5 亿美元的合作,然后在一个月后上市,成为第三家上市的 PROTAC 公司。现在有四个上市公司,累计市值约为 110 亿美元。从细胞中去除疾病蛋白质靶标的小分子的诱人前景催生了至少十种其他生物技术,至少有六家公司已将 PROTAC 样分子带入临床试验(图1)。
靶向蛋白质降解的发展可谓如日中天,2021年7 月,辉瑞公司向 Arvinas 支付了 6.5 亿美元的预付款,外加 3.5 亿美元的股权投资,用于联合开发 PROTAC 降解剂,目前处于第二阶段试验阶段。2021年8 月,拜耳以 15 亿美元的预付款和5 亿美元的潜在里程碑付款收购药物研发公司Vividion Therapeutics。而Kymera 宣布与赛诺菲达成 21.5 亿美元的合作,然后在一个月后上市,成为第三家上市的 PROTAC 公司。
现在有四个上市公司,累计市值约为 110 亿美元。从细胞中去除疾病蛋白质靶标的小分子的诱人前景催生了至少十种其他生物技术,至少有六家公司已将 PROTAC 样分子带入临床试验(图1)。
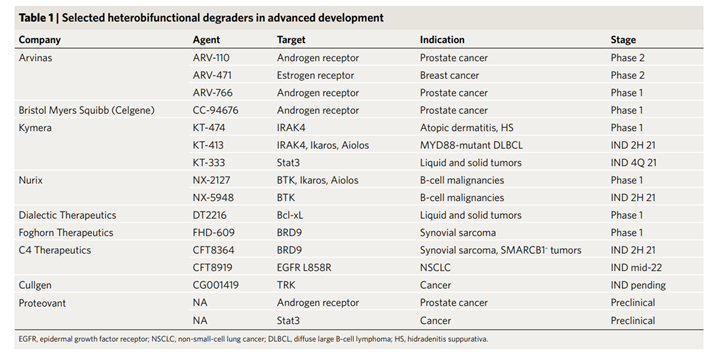
图1 开发PROTAC分子且已经处于临床研究的公司及其研发分子相关信息
通过利用细胞自身的处理系统来选择性降解靶标蛋白的潜力是巨大的。PROTACs 可以降解原本无法成药的致病蛋白,同时克服了传统小分子耐药性。但是,它们能否成为一种主要的新型药物模式还不能确定。
随着PROTACs 的开发,一些局限性也开始出现,它们比传统的小分子更难开发,它们的毒理学不确定,而且副作用很大程度上是未知的。“未来几年将是关键的,临床实验的成功会促使大量投资,这个领域将有可能像生物制剂一样,成为药物研发的一种通用模式”斯坦福大学的有机化学家,也是C4疗法的联合创始人—Nathanael Gray说。
1、蓬勃发展的趋势
PROTAC即蛋白分解靶向嵌合体,通过利用细胞自身的泛素蛋白酶体系统(UPS)来降解靶蛋白。小分子由泛素连接酶的配体、目标蛋白的配体和linker三部分连接,通过使泛素连接酶与靶蛋白接触,触发泛素链的转移,标记并降解靶蛋白(图2)。PROTACs的灵感来自于化学生物学中的诱导接近概念,即自然界中的某些小分子可以通过使两种蛋白质紧密接触而产生作用。
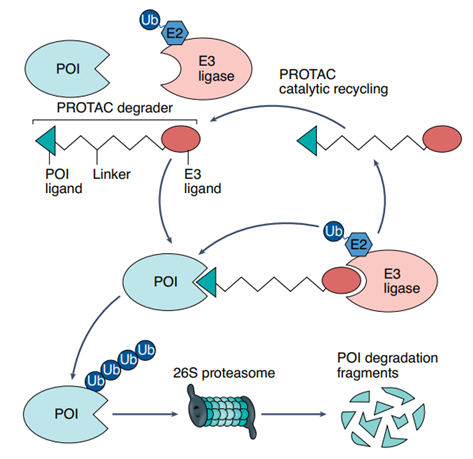
图2 PROTAC的原理
耶鲁大学的化学生物学家克Craig Crews和加州理工学院的生物化学家Ray Deshaies在2001年描述了第一个功能性的PROTAC。通过使得靶蛋白MetAP-2被Skp1–Cullin–F box识别并降解,由于PROTAC分子中E3连接酶配体是一个体积较大的多肽,导致其理化性质不好,并没有实际的商用价值(图3)。
直到2015年,Craig Crews及其同事报道了第一个活性为纳摩尔级别的降解ERRα和PIPK2的PROTAC小分子(图4)。接着在Dana Farber Cancer Institute工作的肿瘤学家Jay Bradner及其团队设计了一种高效、高选择性的招募CRBN的BRD4降解剂。
耶鲁大学的化学生物学家克Craig Crews和加州理工学院的生物化学家Ray Deshaies在2001年描述了第一个功能性的PROTAC。通过使得靶蛋白MetAP-2被Skp1–Cullin–F box识别并降解,由于PROTAC分子中E3连接酶配体是一个体积较大的多肽,导致其理化性质不好,并没有实际的商用价值(图3)。直到2015年,Craig Crews及其同事报道了第一个活性为纳摩尔级别的降解ERRα和PIPK2的PROTAC小分子(图4)。接着在Dana Farber Cancer Institute工作的肿瘤学家Jay Bradner及其团队设计了一种高效、高选择性的招募CRBN的BRD4降解剂。
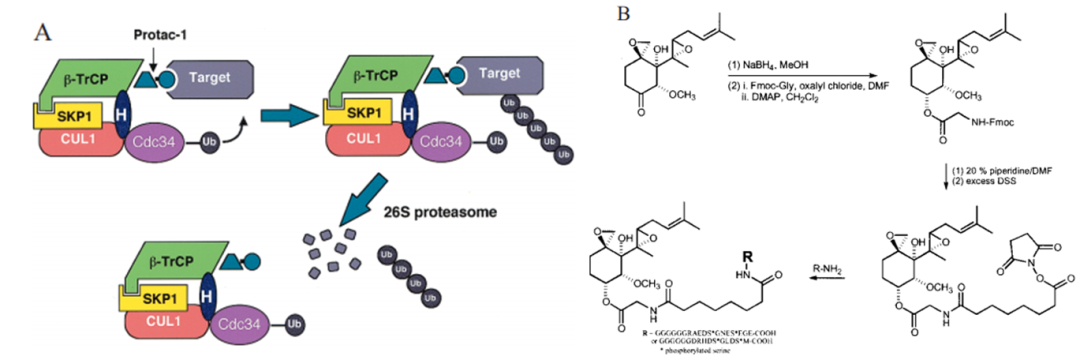
图3 第一个PROTAC分子的结构和作用机制
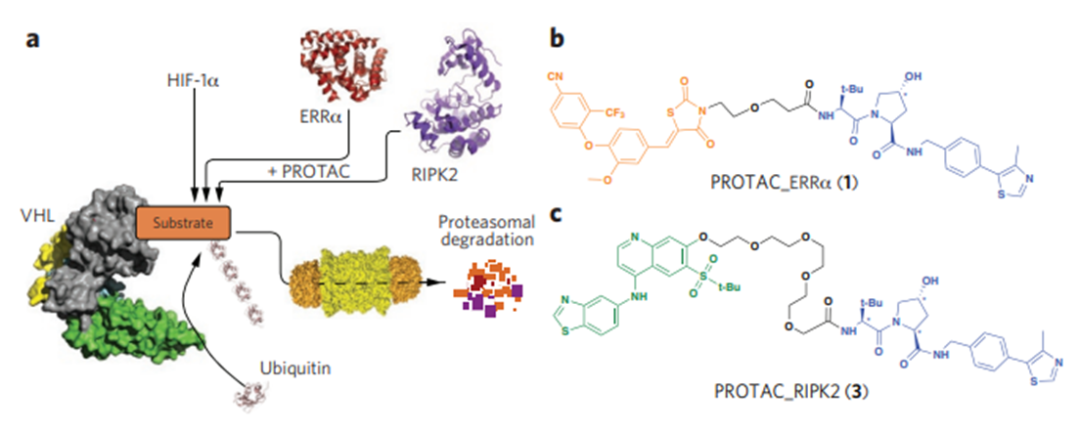
图4 活性在nM级别的PROTAC分子
2、困难重重
虽然PROTAC分子有很多优点,但其开发存在很多困难。与传统的小分子抑制剂相比,它们往往具有较高的分子量(0.7-1.1kDa),更多的氢键供体和更大的极性表面积,这导致其往往存在透膜性差、口服利用度低,且合成相对困难的问题。此外,虽然细胞内有六百多种E3泛素连接酶,但现在主要依赖于VHL和CRBN,因此也有可能产生耐药。药物的设计也很大可能会影响三元复合物的构象,进而影响其降解效率。因此,虽然许多公司已经在一定程度上合理化了 PROTAC 优化过程,但它在很大程度上仍然是经验性的,比开发传统小分子抑制剂更难。
3、剂量超载
因为PROTAC降解是“事件驱动”,而不是“占用驱动”,因此只需要瞬时与靶标蛋白结合,然后药物解离并移动到下一个靶标蛋白,因此PROTAC的理论优势是低剂量。在临床前,极低的 PROTAC 剂量可以显着降低蛋白质水平,而Arvinas 的雄激素受体降解剂 ARV-110 的 2 期剂量为420 毫克,其剂量大的原因是因为化合物的低渗透性和溶解度。我们不难看出口服生物利用度是 PROTAC 开发的一个瓶颈。尽管基于 VHL 的PROTAC 更容易合成,大多数公司都在使用 cereblon 而不是 von Hippel-Lindau (VHL) E3 连接酶来研究口腔降解剂,原因是cereblon 配体具有更好的“类药性”——更低的分子量、更少的氢键供体和更少的可旋转键(图5)。
但是完全依赖 cereblon 可能会限制临床应用,因为在某些组织中,其他连接酶可能更活跃或表达更高。因为PROTAC降解是“事件驱动”,而不是“占用驱动”,因此只需要瞬时与靶标蛋白结合,然后药物解离并移动到下一个靶标蛋白,因此PROTAC的理论优势是低剂量。在临床前,极低的 PROTAC 剂量可以显着降低蛋白质水平,而Arvinas 的雄激素受体降解剂 ARV-110 的 2 期剂量为420 毫克,其剂量大的原因是因为化合物的低渗透性和溶解度。我们不难看出口服生物利用度是 PROTAC 开发的一个瓶颈。
尽管基于 VHL 的PROTAC 更容易合成,大多数公司都在使用 cereblon 而不是 von Hippel-Lindau (VHL) E3 连接酶来研究口腔降解剂,原因是cereblon 配体具有更好的“类药性”——更低的分子量、更少的氢键供体和更少的可旋转键(图5)[3]。但是完全依赖 cereblon 可能会限制临床应用,因为在某些组织中,其他连接酶可能更活跃或表达更高。
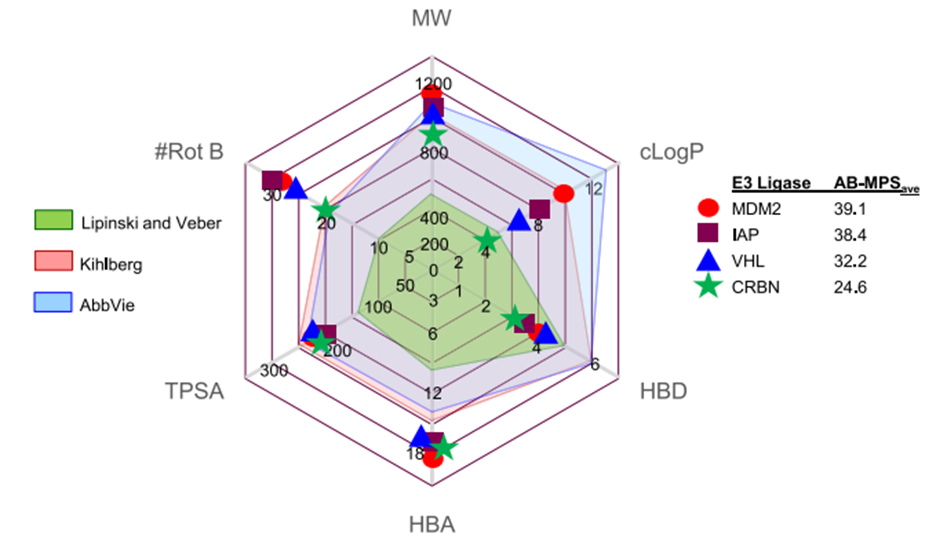
图5 常见的E3泛素连接酶配体的理化性质
4、分子胶水
鉴于PROTAC 的剂量和口服可用性挑战,一些公司正在集中研发另一种降解剂:分子胶水。这些是仅结合 E3 连接酶的“单价”小分子,而不是结合连接酶和靶标的二价 PROTAC。与PROTAC相比,分子胶具有如下优点:分子量小、理化性质较优、更容易成药且不需要在靶蛋白上有结合口袋,而胶水的缺点是很难针对特定的疾病相关蛋白进行降解。分子胶水的发现一般是逆向工作,筛选 E3 结合分子以获得所需的表型或进行蛋白质组学筛选,然后找出它们降解的蛋白质。
5、潜在的副作用
毒理学是PROTAC发展的另一个瓶颈,有可能出现在靶和脱靶的副作用。在靶副作用指的是与抑制蛋白活性相比,降解蛋白所带来的毒性。当然,完全去除蛋白质也可能比仅仅抑制其活性更有效,因此公司需要大型动物模型来评估小分子的毒性。PROTAC 弹头通常对其靶标具有极高的特异性,且活性三元复合物一般来说是一种极具选择性的降解剂,但不排除存在潜在脱靶的可能性,且其脱靶会导致蛋白的降解,导致其对脱靶蛋白的影响也将持续很久。
6、总结与展望
总体来说,PROTAC为开发不可成药蛋白提供了巨大的潜力,虽然其分子设计存在一定的局限性,但为人类疾病的治疗带来了曙光,期待PROTAC分子在临床上能够披荆斩棘,早日为临床用药带来更多的选择。


