Nature证实,不是β淀粉样蛋白导致阿尔兹海默症!
阿尔兹海默症(Alzheimer′s disease, AD)俗称老年痴呆,是一种多发于65岁以上老人的神经系统退行性疾病。
脑内神经细胞外β淀粉样蛋白沉积(又称老年斑)是阿尔兹海默症的主要病变,β淀粉样蛋白学说也被认为是阿尔兹海默症主流的发病机制。
基于此,科学家希望通过抑制β淀粉样蛋白产生、纤维化和沉积,来预防和治疗阿尔兹海默症,然而效果不尽人意,目前已有的药物仅能够延缓病理症状的加重,并不能阻止或逆转疾病进程,且停药后易复发。
知道了很多病理机制,依旧不得其门而入,不禁令我们深思:我们是否真正触及阿尔兹海默症的病根,还是被其表象一叶障目,最终治标不治本?
近期,一项来自美国纽约大学格罗斯曼医学院联合内森克莱恩研究所的最新研究,颠覆了我们对阿尔兹海默症“先有细胞外淀粉样斑块形成,后有神经细胞死亡”的传统印象,提出“先有神经细胞死亡,后有细胞外淀粉样斑块出现”。这么一想,即使清除了细胞外的淀粉样斑块,被害细胞早已死亡,又谈何补救?
研究以“Faulty autolysosome acidification in Alzheimer’s disease mouse models induces autophagic build-up of Aβ in neurons, yielding senile plaques”为题,于6月2日发表在《自然·神经科学》。

研究人员认为阿尔兹海默症的发生,始于神经细胞自噬溶酶体功能障碍,更准确地来说,是“酸化”障碍。
自噬溶酶体由自噬泡与溶酶体融合形成,如果把溶酶体比喻成垃圾处理厂,自噬泡就相当于“垃圾运输车”,将细胞内损伤的蛋白质、核酸、细胞器等运输到溶酶体进行分解消化。
溶酶体内的水解酶需要在酸性环境下才能发挥消化分解作用,而这种酸性环境主要靠质子泵vATPase将细胞质中的H+离子泵入溶酶体内得以实现,一旦溶酶体酸化障碍,垃圾分解的流水线就会停滞,造成大量垃圾中间产物形成并蓄积在溶酶体内,这其中也包括β淀粉样蛋白及其前体蛋白。
当溶酶体承受不住破裂后,溶酶体内的水解酶就会释放进入细胞质中,分解消化细胞,细胞膜瓦解,胞内垃圾泄了一地,最终形成我们看到的“细胞外”淀粉样斑块。也就是说,细胞死亡要先于细胞外淀粉样斑块的形成,甚至可以说这些淀粉样斑块正是死亡的神经细胞混合着β淀粉样蛋白的遗骸。
那么研究人员是如何证明他们的结论呢?
首先他们需要在阿尔兹海默症小鼠中观察到神经细胞的溶酶体出现酸化障碍,并且这一过程是早于细胞死亡以及细胞外淀粉样斑块形成的。
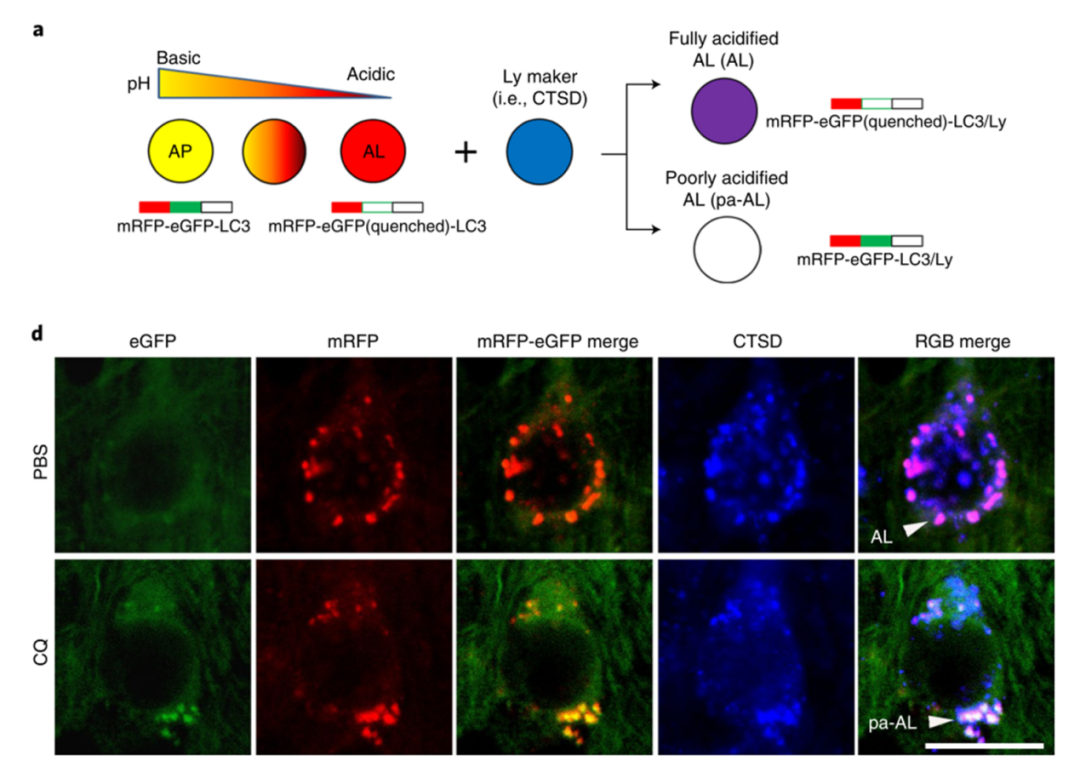
且看他们是怎样区分正常以及酸化障碍的自噬溶酶体的:
用红色-绿色荧光串联探针特异性标记神经细胞内的自噬泡(Thy-1 mRFP-eGFP- LC3,TRGL小鼠),此时自噬泡的红色荧光和绿色荧光融合在一起,发出黄色荧光。
当自噬体与溶酶体结合后,受溶酶体内酸性环境影响,黄色荧光又逐渐变成红色荧光,再加上溶酶体自带的蓝色荧光标志(CTSD),最后形成的自噬溶酶体呈现紫色荧光,这是酸化功能正常的自噬溶酶体。
如果溶酶体酸化功能障碍,则融合后自噬体黄色荧光不变红,加上溶酶体自带的蓝色荧光标志,最后形成的自噬溶酶体呈现白色荧光,这是酸化功能障碍的自噬溶酶体。
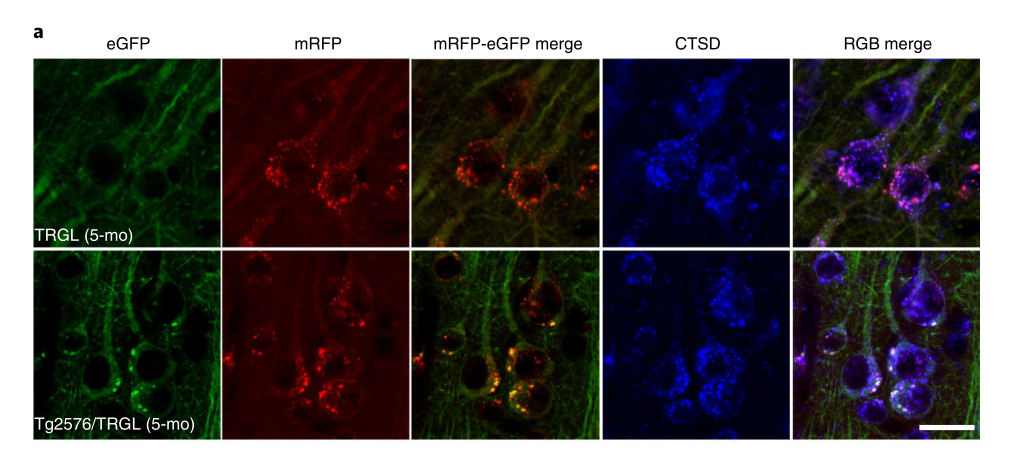
当这种探针应用到阿尔兹海默症的模型小鼠身上时,研究人员观察到小鼠在生后5个月大脑新皮质区域90%的自噬溶酶体就已经出现酸化障碍,比它们出现脑部淀粉样斑块的时间(10-12个月),早了至少5个月。
在早发型阿尔兹海默症模型5xFAD小鼠身上,自噬溶酶体酸化障碍出现的时间还要更早,在2月龄的5xFAD小鼠脑部就可以发现酸化障碍的自噬溶酶体以及神经细胞退化的表现。
相应的是,这些Tg2567小鼠在生后6个月时,它们神经细胞溶酶体上的质子泵vATPase活性和同龄的野生型小鼠相比明显下降(65.6 ± 4.1%),到了第12个月时,更是连一半都不到(45.3 ± 3.7%)。
酸化障碍的自噬溶酶体不能消化损伤的蛋白质,造成垃圾中间产物——β淀粉样前体蛋白的产物(APP-βCTF)以及β淀粉样蛋白堆积在自噬溶酶体内。
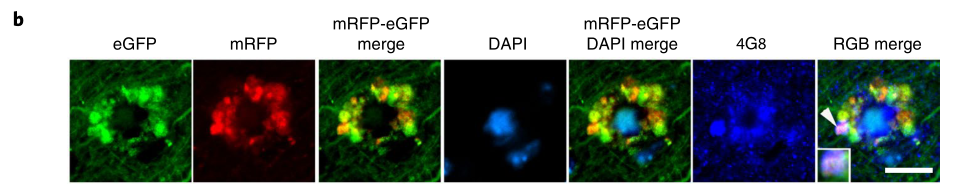
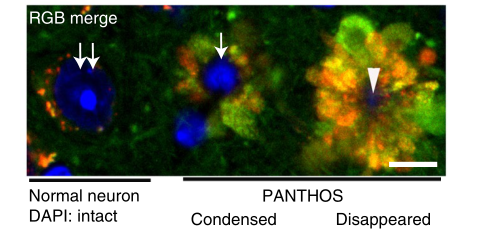
不仅如此,这些自噬溶酶体就像一片片花瓣一样,在细胞核周围互相融合,形成花冠样结构,研究人员称之为PANTHOS(毒花),体内含有毒花的神经细胞又被称为“毒花神经元”。
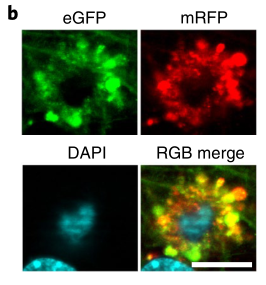
随着病情进展,“毒花神经元”除了细胞内β淀粉样蛋白增多,还逐渐向老年斑的方向发展,如果说2.2月龄的5xFAD小鼠脑内只有一半的“毒花神经元” 的老年斑标志物阳性,在6月龄5xFAD小鼠这一比例已经超过95%。
最终,毒花中心的细胞核消失,溶酶体通透性增加,溶酶体内的酶释放进入细胞质,神经细胞细胞膜完整性消失,宣告细胞死亡,遗骸成为了我们看到的 “细胞外斑块”,越来越多的“毒花神经元”聚集在一起,斑块面积进一步增大。
对于踟蹰不前的阿尔兹海默症治疗,这项研究无异于 “拨开云雾见天日”,阿尔兹海默症的病因不在细胞外,而在于细胞内。而减少斑块生成,避免细胞死亡,关键在于“修好垃圾处理厂”,恢复溶酶体的酸化功能。
事实上,该团队今年4月发表在Science Advances上的研究已经证明通过改善溶酶体酸化功能,能够显著减轻阿尔兹海默症小鼠神经损伤!
希望这一次我们是真正走在一条通往真相与希望的道路上。


